James McCully estaba en el laboratorio extrayendo unas estructuras diminutas llamadas mitocondrias de las células cuando investigadores de su equipo entraron corriendo. Habían estado operando un corazón de cerdo y no conseguían que volviera a bombear con normalidad.
McCully estudia la prevención de daños cardíacos en el Boston Children’s Hospital y la Facultad de Medicina de Harvard, y estaba muy interesado en las mitocondrias. Estos orgánulos productores de energía son especialmente importantes para órganos como el corazón, que tienen grandes necesidades energéticas. McCully se preguntaba si el trasplante de mitocondrias sanas a corazones dañados podría restaurar su función.
LEA MÁS: ¿Cómo detectar una falla cardiaca?
Decidió intentarlo. Llenó una jeringa con las mitocondrias extraídas y las inyectó directamente en el corazón. Comenzó a latir con normalidad.
Desde aquel día, hace casi 20 años, McCully y otros investigadores han replicado ese éxito en cerdos y otros animales. Los trasplantes en seres humanos fueron el siguiente paso, en bebés con complicaciones tras una cirugía cardíaca. Esto dio lugar a un nuevo campo de investigación que usa el trasplante de mitocondrias para tratar órganos dañados y enfermedades.
En los últimos cinco años, cada vez más científicos exploran el trasplante de mitocondrias para tratar daños cardíacos tras un paro cardíaco, daños cerebrales tras un accidente cerebrovascular y daños en órganos destinados a ser trasplantados.
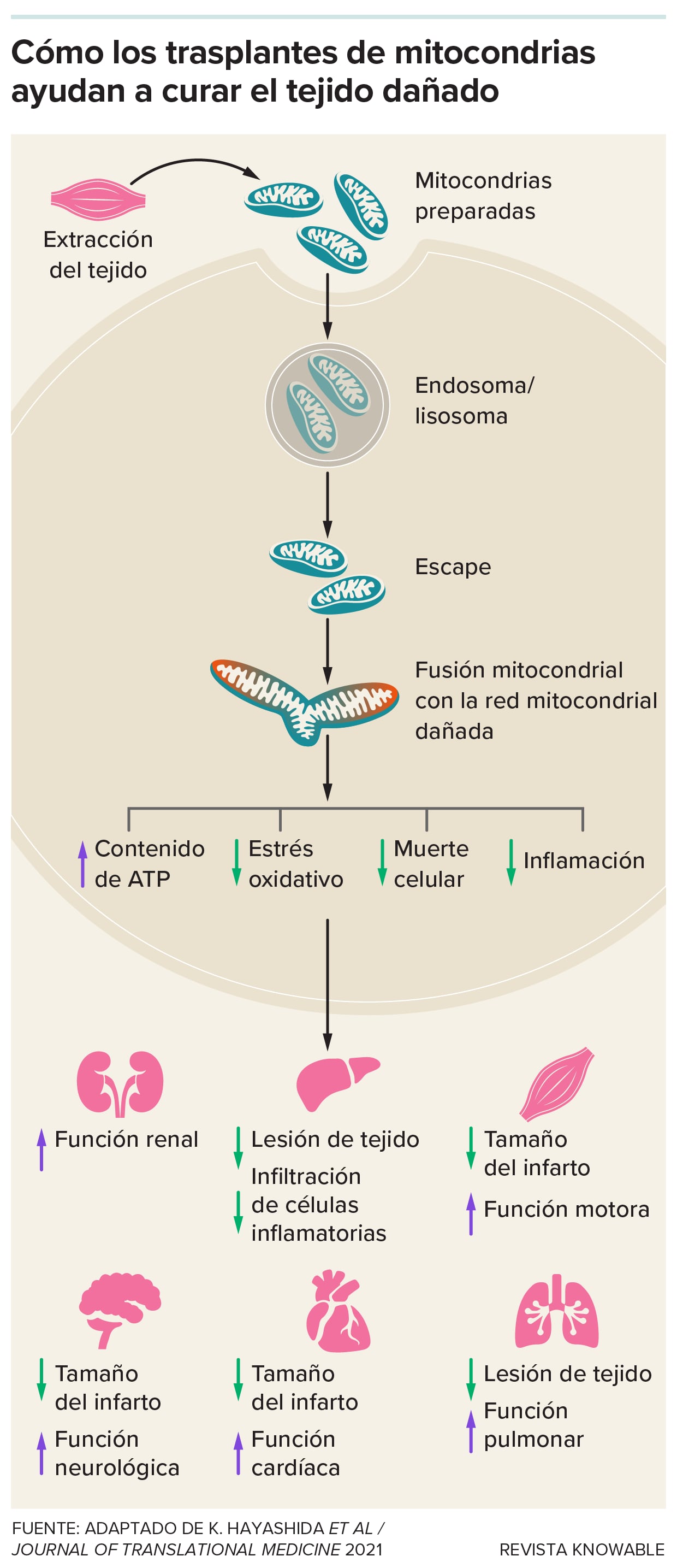
Las mitocondrias son más conocidas por producir energía utilizable para las células. Pero también envían señales moleculares que ayudan a mantener el equilibrio del cuerpo y a gestionar sus respuestas inmunitarias y al estrés.
Algunos tipos de células pueden donar de forma natural mitocondrias sanas a otras células que las necesitan, como las células cerebrales tras un accidente cerebrovascular, en un proceso denominado transferencia mitocondrial. Por lo tanto, la idea de potenciar este proceso mediante el trasplante de mitocondrias para revitalizar el tejido dañado tenía sentido.
A partir de estudios en células cardíacas de conejos y ratas, el grupo de McCully encontró que las membranas plasmáticas de las células envuelven las mitocondrias y las transportan al interior, donde se fusionan con las mitocondrias internas de la célula. Allí, parecen provocar cambios moleculares que ayudan a recuperar la función cardíaca: al comparar corazones de cerdos privados de sangre y oxígeno tratados con mitocondrias con otros que recibieron placebos, el grupo de McCully observó diferencias en la actividad de genes y proteínas que indicaban menos muerte celular y menos inflamación.
Mitocondrias para salvar a bebés
Hace unos 10 años, Sitaram Emani, cirujano cardíaco del Boston Children’s Hospital, contactó a McCully. Emani había observado que algunos bebés con defectos cardíacos no se recuperaban completamente tras sufrir complicaciones en la cirugía cardíaca y se preguntaba si el trasplante de mitocondrias podría ayudar.
En una cirugía para reparar defectos cardíacos, los cirujanos utilizan un fármaco para detener el corazón y así poder operar. Pero si el corazón se ve privado de sangre y oxígeno durante demasiado tiempo, las mitocondrias comienzan a fallar y las células empiezan a morir. Cuando la sangre comienza a fluir de nuevo, en lugar de devolver el corazón a su estado normal, puede dañar y matar más células.
Dado que los ocho años de estudios de McCully en conejos y cerdos no habían revelado problemas de seguridad con el trasplante de mitocondrias, McCully y Emani pensaron que valía la pena probar el procedimiento en bebés con pocas probabilidades de recuperar la función cardíaca suficiente para dejar el soporte cardiopulmonar.

Los padres de 10 pacientes aceptaron someterse al procedimiento experimental. El programa piloto se llevó a cabo entre 2015 y 2018. McCully extrajo muestras de músculo del tamaño de un borrador de un lápiz de las incisiones realizadas para la cirugía cardíaca, usó una técnica de filtración para aislar las mitocondrias e inyectó los orgánulos en el corazón del bebé.
Ocho de esos 10 bebés recuperaron la función cardíaca suficiente para dejar de necesitar soporte vital, en comparación con solo cuatro de 14 casos similares entre 2002 y 2018, informó el equipo en 2021.
La terapia también acortó el tiempo de recuperación: dos días en promedio en el grupo de trasplante mitocondrial, en comparación con nueve días en el grupo de control.
Dos pacientes no sobrevivieron: en uno, la intervención se produjo después de que el resto de los órganos del bebé comenzaran a fallar y, en otro, se desarrolló un problema pulmonar cuatro meses después. Ya se ha realizado este procedimiento en 17 bebés.
El procedimiento sigue siendo experimental y aún no es práctico para un uso clínico más amplio, pero McCully espera que algún día pueda utilizarse para tratar lesiones renales, pulmonares, hepáticas y de las extremidades causadas por la interrupción del flujo sanguíneo.
Mitocondrias para ayudar al cerebro
Los resultados han inspirado a otros médicos cuyos pacientes sufren lesiones similares. Una de ellas es el ictus isquémico, en el que los coágulos impiden que la sangre llegue al cerebro. Se pueden disolver o eliminar físicamente los coágulos, pero no existe ningún método para proteger el cerebro del daño.
Melanie Walker, neurocirujana endovascular de la Facultad de Medicina de la Universidad de Washington en Seattle se topó con los estudios de trasplante mitocondrial de McCully hace 12 años y le llamó especialmente la atención un informe sobre ratones realizado por investigadores del Hospital General de Massachusetts y la Facultad de Medicina de Harvard que demostraba que las células de apoyo y protección del cerebro —los astrocitos— podían transferir parte de sus mitocondrias a las neuronas dañadas por un accidente cerebrovascular para ayudarlas a recuperarse. Quizás, pensó, el trasplante de mitocondrias también podría ayudar en accidentes cerebrovasculares en humanos.
Pasó años trabajando con investigadores en animales para descubrir cómo administrar mitocondrias al cerebro de forma segura. Probó la seguridad del procedimiento en un ensayo clínico con solo cuatro personas con ictus isquémico.
Los resultados, publicados en 2024 en la revista Journal of Cerebral Blood Flow & Metabolism, muestran que los pacientes a los que se les administró el tratamiento no sufrieron ningún daño; el ensayo no estaba diseñado para evaluar la eficacia. El grupo de Walker está reclutando participantes para evaluar más a fondo la seguridad. El siguiente paso será determinar si las mitocondrias llegan a donde deben llegar y si funcionan.
Preservar órganos para trasplantes
Los investigadores esperan que la donación de órganos también pueda beneficiarse de los trasplantes de mitocondrias. Los órganos donados sufren daños cuando carecen de riego sanguíneo durante demasiado tiempo.
Para comprobar si los trasplantes mitocondriales pueden revitalizarlos, el cirujano y científico especialista en trasplantes Giuseppe Orlando, de la Facultad de Medicina de la Universidad Wake Forest en Winston-Salem, y sus colegas inyectaron mitocondrias en cuatro riñones de cerdo y una sustancia de control en otros tres. En 2023, en la revista Annals of Surgery, informaron de que había menos células muertas en los riñones tratados con mitocondrias y mucho menos daño.
Aún es pronto, afirma Orlando, pero confía en que el trasplante de mitocondrias pueda convertirse en una herramienta valiosa para rescatar órganos subóptimos para la donación.
Los estudios suscitan tanto entusiasmo como escepticismo.
“Sin duda, es un campo muy interesante”, afirma Koning Shen, bióloga mitocondrial postdoctoral de la Universidad de California, Berkeley, y coautora de una reseña sobre las funciones de señalización de las mitocondrias publicada en el Annual Review of Cell and Developmental Biology de 2022.
Añade que ampliar la extracción de mitocondrias y aprender a almacenar y conservar los orgánulos aislados son los principales obstáculos para que estos tratamientos se conviertan en una realidad a mayor escala.
“Hay mucha gente inteligente estudiando esto detenidamente, pero creo que la gran pregunta es: ¿cuál es el mecanismo?”, afirma Navdeep Chandel, investigador de mitocondrias de la Universidad Northwestern en Chicago.
Duda que las mitocondrias de donantes reparen o sustituyan los orgánulos nativos disfuncionales, pero afirma que es posible que las mitocondrias donadas desencadenen señales inmunitarias que benefician indirectamente al tejido dañado.
Sea cual sea el mecanismo, algunos estudios en animales sugieren que las mitocondrias deben ser funcionales para transmitir sus beneficios.
Lance Becker, presidente de medicina de urgencias en Northwell Health, en Nueva York, que estudia el papel de las mitocondrias en el paro cardíaco, llevó a cabo un estudio en el que comparó mitocondrias frescas, mitocondrias que habían sido congeladas y luego descongeladas, y un placebo para tratar ratas tras un paro cardíaco. Las 11 ratas que recibieron mitocondrias frescas y funcionales tuvieron una mejor función cerebral y una mayor tasa de supervivencia tres días después que las 11 ratas que recibieron un placebo; las mitocondrias congeladas y descongeladas no aportaron estos beneficios.
Según los científicos, se necesitan más estudios sobre los mecanismos de la terapia mitocondrial, mejores técnicas de administración, ensayos más amplios y un conjunto de casos de éxito documentados antes de que los trasplantes mitocondriales sean aprobados por la FDA y se utilicen ampliamente.
“Estamos en una fase muy inicial, no sabemos cómo funciona”, afirma Becker. “Pero sabemos que está haciendo algo muy interesante”.
Este artículo apareció originalmente en Knowable en español, una publicación sin ánimo de lucro dedicada a poner el conocimiento científico al alcance de todos. Suscríbase al boletín de Knowable en español.